Qual è la differenza tra grafene e grafite?
Un notevole elemento chimico, il carbonio è quello che si trova convenientemente al numero 6 nel quattordicesimo gruppo del secondo periodo della tavola periodica degli elementi chimici. Sin dai tempi antichi, le persone conoscevano il diamante e la grafite, due delle oltre nove modifiche allotropiche di questo elemento finora scoperte. A proposito, è il carbonio che ha il numero più grande, rispetto ad altre sostanze, di modifiche allotropiche conosciute dalla scienza moderna.
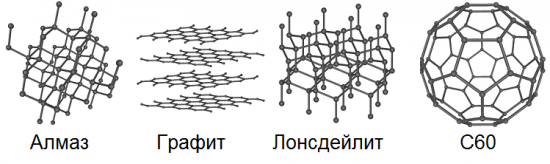
L'allotropia implica la possibilità dell'esistenza in natura dello stesso elemento chimico sotto forma di due o più sostanze semplici, le cosiddette forme allotropiche o modificazioni allotropiche, che causano differenze in queste sostanze sia nella struttura che nelle proprietà. Quindi, il carbonio ha 8 di queste forme base: diamante, grafite, lonsdaleite, fullereni (C60, C540 e C70), carbonio amorfo e nanotubo a parete singola.
Tra queste forme di carbonio ci sono proprietà e carattere completamente diversi: sostanze morbide e dure, trasparenti e opache, economiche e costose. Tuttavia, confrontiamo due modifiche del carbonio simili: grafite e grafene.

Conosciamo tutti i graffiti dai tempi della scuola.La mina di una normale matita è esattamente grafite. È abbastanza morbido, scivoloso e untuoso al tatto, i cristalli sono lastre, gli strati di atomi si trovano uno sopra l'altro, quindi quando si strofina, ad esempio, su carta, i singoli fiocchi della struttura cristallina stratificata della grafite si staccano facilmente , lasciando una caratteristica traccia scura sulla carta.
La grafite conduce bene la corrente elettrica, la sua resistenza è in media di 11 Ohm * mm2 / m, ma la conduttività della grafite non è la stessa a causa della naturale anisotropia dei suoi cristalli. Pertanto, la conducibilità lungo i piani del cristallo è centinaia di volte superiore alla conducibilità in questi piani. La densità della grafite va da 2,08 a 2,23 g / cm3.
In natura la grafite si forma ad alte temperature nelle rocce ignee e vulcaniche, negli skarn e nelle pegmatiti. Si verifica in vene di quarzo con minerali in depositi polimetallici idrotermali a temperatura intermedia. È ampiamente distribuito nelle rocce metamorfiche.
Così, dal 1907, sull'isola del Madagascar sono state sviluppate le più grandi riserve mondiali di grafite lamellare naturale. L'isola è costituita da rocce metamorfiche precambriane che salgono in superficie in un terreno montuoso con segni ipsometrici di 4.000-4.600 piedi. La grafite si trova qui in una cintura lunga 400 miglia e domina le montagne nella parte orientale del centro dell'isola.
Il grafene, a differenza della grafite, non ha una struttura cristallina di massa; presenta un reticolo cristallino esagonale bidimensionale, spesso un solo atomo. In una tale modifica allotropica, il carbonio non si trova affatto in natura, ma può teoricamente essere ottenuto artificialmente. Possiamo dire che un piano deliberatamente separato dalla struttura cristallina multistrato della grafite sarà proprio questo grafene.
Inizialmente gli scienziati non erano in grado di ottenere il grafene sotto forma di un semplice film bidimensionale, a causa dell'instabilità della materia in questa forma. Tuttavia, su un substrato di ossido di silicio (grazie al legame con lo strato dielettrico) era ancora possibile ottenere grafene dello spessore di un atomo: nel 2004 gli scienziati russi Andrey Geim e Konstantin Novoselov dell'Università di Manchester pubblicarono un rapporto su Science sull'ottenimento del grafene in questo modo.
E anche oggi sono giustificati metodi così semplici per ottenere grafene per la ricerca, come l'esfoliazione meccanica di un monostrato di carbonio da un cristallo di grafite sfuso usando nastro adesivo (e metodi simili).
I ricercatori ritengono che grazie ai loro progressi emergerà presto una nuova classe di nanoelettronica basata sul grafene, in cui i transistor ad effetto di campo avranno uno spessore inferiore a 10 nm. Il fatto è che la mobilità degli elettroni nel grafene è così elevata (10.000 cm2 / V * s) che sembra essere oggi l'alternativa più promettente al silicio convenzionale.
L'elevata mobilità dei portatori è la capacità di elettroni e lacune di rispondere in modo estremamente rapido all'effetto dei campi elettrici applicati, e questo è estremamente importante per i transistor ad effetto di campo, l'unità operativa di base dell'elettronica moderna.
Ci sono anche prospettive per la creazione di vari sensori biologici e chimici, nonché film sottili per dispositivi fotovoltaici e touch screen. Nonostante tutto ciò, la conducibilità termica del grafene è 10 volte superiore a quella del rame, e questo criterio è sempre molto importante per l'elettronica.