Gli elettroni si comportano come onde
I fisici sanno da tempo che la luce è un'onda elettromagnetica. Fino ad oggi nessuno dubita di questa posizione, poiché la luce mostra chiaramente tutti i segni del comportamento ondulatorio: le onde luminose possono sovrapporsi l'una all'altra, generando uno schema di interferenza, sono anche in grado di separarsi, piegandosi attorno agli ostacoli lungo il tempo di diffrazione.
Quando vediamo un uccello che cammina come un'anatra, nuota come un'anatra e fa starnazzare come un'anatra, chiamiamo quell'uccello un'anatra. Quindi la luce è Onda elettromagneticabasato su segni oggettivamente osservati del comportamento di tale onda alla luce.

Tuttavia, alla fine del XIX e XX secolo, i fisici avrebbero iniziato a parlare del «dualismo particella-onda» della luce. Si scopre che la conoscenza che la luce è un'onda elettromagnetica non è tutto ciò che la scienza conosce della luce. Gli scienziati hanno scoperto una caratteristica molto interessante nella luce.
Si scopre che in qualche modo la luce si manifesta COME il comportamento di un flusso di particelle in qualche modo.Si è constatato che l'energia trasportata dalla luce, dopo essere stata contata per un certo periodo di tempo da un apposito rivelatore, risulta essere comunque composta da singoli pezzi (interi).
Pertanto, è diventato vero che l'energia della luce è discreta, perché è composta, per così dire, da singole particelle - "quanta", cioè dalle più piccole porzioni intere di energia. Una tale particella di luce, che trasportava un'unità (o quanto) di energia, venne chiamata fotone.
L'energia di un fotone si trova con la seguente formula:
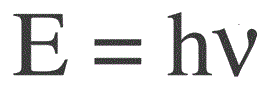
E — energia del fotone, h — costante di Planck, v — frequenza.
Il fisico tedesco Max Planck per primo stabilì sperimentalmente il fatto della discretezza dell'onda luminosa e calcolò il valore della costante h, che compare nella formula per trovare l'energia dei singoli fotoni. Questo valore si è rivelato essere: 6.626 * 10-34 J * s. Planck pubblicò i risultati del suo lavoro alla fine del 1900.

Considera, ad esempio, un raggio viola. La frequenza di tale luce (f o v) è 7,5 * 1014 Hz, la costante di Planck (h) è 6,626 * 10-34 J * s. Ciò significa che l'energia del fotone, (E), caratteristica del colore viola, è 5 * 10-19 J. Si tratta di una porzione di energia così piccola che è molto difficile da catturare.
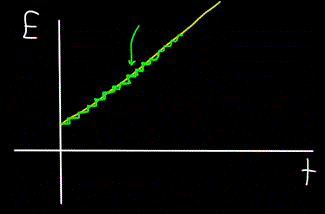
Immagina un ruscello di montagna: scorre come un'unità ed è impossibile vedere ad occhio nudo che il flusso è effettivamente costituito da singole molecole d'acqua. Oggi, tuttavia, sappiamo che l'oggetto macroscopico, il flusso, è in realtà discreto, cioè costituito da singole molecole.
Ciò significa che se possiamo posizionare un contatore di molecole accanto al flusso per contare le molecole d'acqua che passano mentre il flusso scorre, il rilevatore conterà sempre solo numeri interi di molecole d'acqua, non parziali.
Analogamente, il grafico dell'energia totale del fotone E, calcolato all'istante t — risulterà sempre non lineare (figura gialla), ma a gradini (figura verde):
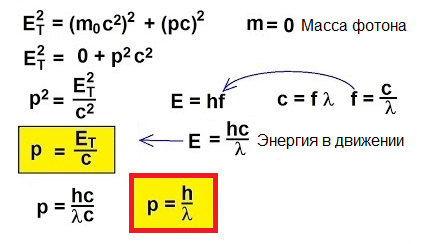
Quindi, i fotoni si muovono, trasportano energia, quindi hanno quantità di moto. Ma un fotone non ha massa. Come puoi allora trovare lo slancio?
Infatti, per oggetti che si muovono a velocità prossime a quella della luce, la formula classica p = mv è semplicemente inapplicabile. Per capire come trovare la quantità di moto in questo caso insolito, passiamo alla relatività ristretta:
Nel 1905, Albert Einstein spiegò da questo punto di vista effetto fotoelettrico… Sappiamo che la lamina metallica ha al suo interno degli elettroni, che al suo interno sono attratti dai nuclei caricati positivamente degli atomi e sono quindi trattenuti nel metallo. Ma se fai brillare una lastra del genere con la luce di una CERTA frequenza, allora puoi far uscire gli elettroni dalla lastra.
È come se la luce si comportasse come un flusso di particelle con quantità di moto e anche se un fotone non ha massa, in qualche modo interagisce comunque con un elettrone in un metallo, e in certe condizioni un fotone è in grado di mettere fuori uso un elettrone.
Quindi, se un fotone incidente sulla piastra ha energia sufficiente, allora l'elettrone verrà espulso dal metallo e uscirà dalla piastra con velocità v. Un tale elettrone eliminato è chiamato fotoelettrone.
Poiché l'elettrone eliminato ha una massa nota m, avrà una certa energia cinetica mv.
L'energia del fotone, quando ha agito sul metallo, viene convertita nell'energia dell'uscita dell'elettrone dal metallo (funzione di lavoro) e nell'energia cinetica dell'elettrone, in possesso della quale l'elettrone eliminato inizia a muoversi fuori dal metallo, lasciandolo.
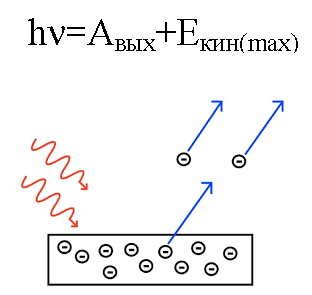
Supponiamo che un fotone di lunghezza d'onda nota colpisca la superficie di un metallo di cui sia nota la funzione lavoro (di un elettrone dal metallo). In questo caso si può facilmente trovare l'energia cinetica di un elettrone emesso da un dato metallo, così come la sua velocità.
Se l'energia del fotone non è sufficiente affinché l'elettrone svolga la funzione di lavoro, allora l'elettrone semplicemente non può lasciare la superficie del metallo dato e il fotoelettrone non si forma.
Nel 1924, un fisico francese Luigi di Broglie proporre un'idea rivoluzionaria secondo la quale non solo i fotoni di luce ma gli stessi elettroni possono comportarsi come onde. Lo scienziato ha persino derivato una formula per l'ipotetica lunghezza d'onda dell'elettrone. Queste onde furono successivamente chiamate "onde di de Broglie".
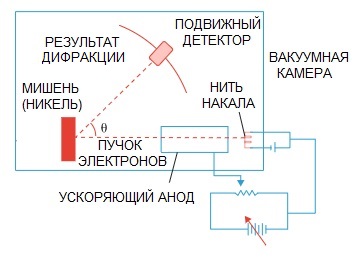
L'ipotesi di De Broglie fu successivamente confermata. Un esperimento di fisica sulla diffrazione di elettroni, condotto nel 1927 dagli scienziati americani Clinton Davison e Lester Germer, ha finalmente evidenziato la natura ondulatoria dell'elettrone.
Quando un raggio di elettroni è stato diretto attraverso una speciale struttura atomica, sembra che il rivelatore avrebbe dovuto registrare l'immagine come particelle che volavano una dopo l'altra, cosa che ci si aspetterebbe logicamente se gli elettroni fossero particelle.
Ma in pratica abbiamo un'immagine caratteristica della diffrazione delle onde. Inoltre, le lunghezze di queste onde sono del tutto coerenti con il concetto proposto da de Broglie.
In definitiva, l'idea di de Broglie ha permesso di spiegare il principio del modello atomico di Bohr, e in seguito ha permesso a Erwin Schrödinger di generalizzare queste idee e gettare le basi della moderna fisica quantistica.
