Elettrolisi. Esempi di calcolo
 L'elettrolisi è la decomposizione di un elettrolita (una soluzione di sali, acidi, basi) per mezzo di una corrente elettrica.
L'elettrolisi è la decomposizione di un elettrolita (una soluzione di sali, acidi, basi) per mezzo di una corrente elettrica.
L'elettrolisi può essere eseguita solo con corrente continua. Durante l'elettrolisi, l'idrogeno o il metallo contenuto nel sale viene rilasciato all'elettrodo negativo (catodo). Se l'elettrodo positivo (anodo) è di metallo (di solito lo stesso del sale), l'elettrodo positivo si dissolve durante l'elettrolisi. Se l'anodo è insolubile (ad es. carbonio), il contenuto di metallo dell'elettrolita diminuisce durante l'elettrolisi.
La quantità di sostanza rilasciata durante l'elettrolisi al catodo è proporzionale alla quantità di elettricità che è passata attraverso l'elettrolita.
La quantità di sostanza rilasciata da un coulomb di elettricità è chiamata l'equivalente elettrochimico di A, quindi G = A • Q; SOL = LA • I • t,
dove G è la quantità di sostanza isolata; Q è la quantità di elettricità; io — corrente elettrica; t è il tempo.
Ogni metallo ha il suo equivalente elettrochimico A.
Esempi di calcolo
1. Quanto rame verrà rilasciato dal solfato di rame (CuSO4) (Fig. 1) con una corrente I = 10 A per 30 minuti.Equivalente elettrochimico del rame A = 0,329 mg/A • sec.
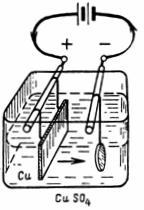
Riso. 1. Schema per esempio 1
G = LA • I • t = 0,329 • 10 • 30 • 60 = 5922 mg = 5,922 g.
Un oggetto sospeso al catodo rilascerà 5,9 g di rame puro.
2. Densità di corrente consentita nel rivestimento elettrolitico di rame • = 0,4 A / dm2. L'area del catodo da ricoprire di rame è S = 2,5 dm2. Quale corrente è necessaria per l'elettrolisi e quanto rame viene rilasciato al catodo in 1 ora (Fig. 2).
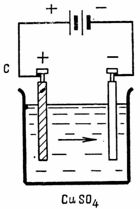
Riso. 2. Schema per esempio 2
I = •• S = 0,4-2,5 = l A; G = LA • Q = LA • I • t = 0,329 • 1 • 60 • 60 = 1184,4 mg.
3. L'acqua ossidata (ad esempio una soluzione debole di acido solforico H2SO4) durante l'elettrolisi si decompone in idrogeno e ossigeno. Gli elettrodi possono essere di carbonio, stagno, rame, ecc., ma il platino è il migliore. Quanto ossigeno verrà rilasciato all'anodo e quanto idrogeno verrà rilasciato al catodo in 1/4 d'ora con una corrente di 1,5 A. La quantità di elettricità 1 A sec rilascia 0,058 cm3 di ossigeno e 0,116 cm3 di idrogeno (Fig. 3).
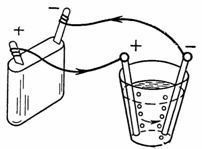
Riso. 3. Schema per esempio 3
Ga = A • I • t = 0,058 • 1,5 • 15 • 60 = 78,3 cm3 di ossigeno verranno rilasciati al catodo.
Gc = A • I • t = 0,1162 • 1,5 • 15 • 60 = 156,8 cm3 di idrogeno verranno rilasciati all'anodo.
Una miscela di idrogeno e ossigeno in questo rapporto è chiamata gas esplosivo che, una volta acceso, esplode formando acqua.
4. L'ossigeno e l'idrogeno per esperimenti di laboratorio si ottengono utilizzando elettrolisi dell'acqua (acido solforico ossidato) (Fig. 4). Gli elettrodi di platino sono saldati nel vetro. Usando la resistenza, impostiamo la corrente I = 0,5 A. (Una batteria di tre celle a secco da 1,9 V viene utilizzata come fonte di corrente) Quanto idrogeno e ossigeno verranno rilasciati dopo 30 minuti.
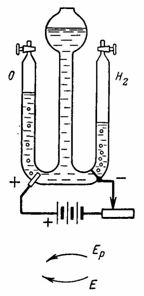
Riso. 4… Figura 4 per esempio
Nel recipiente di destra, Gc = A • I • t = 0,1162 • 0,5 • 30 • 60 = 104,58 cm3 di idrogeno verranno rilasciati.
Nel vaso di sinistra, si svilupperanno Ga = A • l • t = 0,058 • 0,5 • 30 • 60 = 52,2 cm3 di ossigeno (i gas spostano l'acqua nel vaso di mezzo).
5. Il blocco convertitore (motore-generatore) fornisce corrente per ottenere rame elettrolitico (puro). In 8 ore dovresti ottenere 20 kg di miele. Quale corrente dovrebbe fornire il generatore? • L'equivalente elettrochimico del rame è A = 0,329 mg/A • sec.
Poiché G = A • I • t, allora I = G / (A • t) = 20.000.000 / (0,329 • 8 • 3600) = 20.000.000 / 9475,2 = 2110,7 A.
6. È necessario cromare 200 fari, di cui sono necessari 3 g di cromo per ciascuno. Quale corrente è necessaria per fare questo lavoro in 10 ore (equivalente elettrochimico di cromo A = 0,18 mg/A • sec).
I = SOL / (A • t) = (200 • 3 • 1000) / (0,18 • 10 • 3600) = 92,6 A.
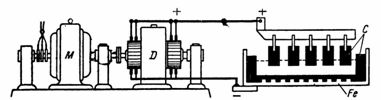
7. L'alluminio si ottiene per elettrolisi di una soluzione di caolino e criolite in bagni a una tensione di lavoro del bagno di 7 V e una corrente di 5000 A. Gli anodi sono fatti di carbone e il bagno è fatto di acciaio con carbone blocchi (figura 5).
Riso. 5Figura 5 per esempio
I bagni di produzione dell'alluminio sono collegati in serie per aumentare la tensione di lavoro (ad esempio, 40 bagni). Per produrre 1 kg di alluminio sono necessari circa 0,7 kg di anodi di carbonio e 25-30 kWh di elettricità. Sulla base dei dati forniti, determinare la potenza del generatore, il consumo di energia per 10 ore di funzionamento e il peso dell'alluminio risultante.
Potenza del generatore quando si lavora su 40 bagni P = U • I = 40 • 7 • 5000 = 1400000 W = 1400 kW.
Energia elettrica consumata per 10 ore, A = P • t = 1400 kW 10 h = 14000 kW • h.
La quantità di alluminio ottenuta G = 14000:25 = 560 kg.
Sulla base dell'equivalente elettrochimico teorico, la quantità di alluminio ottenuta dovrebbe essere pari a:
GT = A • I • t = 0,093 • 5000 • 40 • 10 • 3600 = 0,093 • 720.000.000 mg = 669,6 kg.
L'efficienza dell'impianto elettrolitico è pari a: Efficienza = G / GT = 560 / 669,6 = 0,83 = 83%.